Kurkumina (diferuilomatan) jest głównym (kłącze zawiera od 0,3 do 5,4% tego związku) żółtym pigmentem obecnym w kłączach kurkumy (Curcuma longa L. Zingiberaceae) i pokrewnych gatunków . Stosowana jest ona jako przyprawa, głównie do barwienia potraw, np. ryżu. Oprócz kurkuminy surowa kurkuma zawiera 4-14% olejków lotnych, w tym turmeron, atlanton i zingiberon. Składniki te również wykazują właściwości lecznicze, a nawet w pewnych warunkach mogą stanowić główny aktywny komponent kłącza.
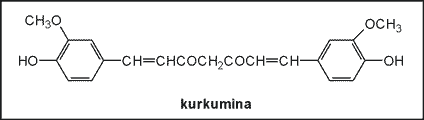
Kurkumina nie jest rozpuszczalna w wodzie, ale rozpuszcza się w alkoholu. Kurkumina wykazuje szeroki wachlarz właściwości farmakologicznych i biologicznych, w tym właściwości przeciwzapalne. Jest również przeciwutleniaczem (antyoksydantem). Kłącze kurkumy zawiera również oporne na temperaturę białko, które jest nawet bardziej skuteczne przeciw reaktywnym formom tlenu (zwłaszcza rodnikowi ponadtlenkowemu) niż sama kurkumina, a także jest bardziej efektywne w hamowaniu uszkodzeń DNA przez reaktywne formy tlenu. Tradycyjnie kłącze kurkumy jest stosowane w stanach zapalnych żołądka i jelit, wzdęciach, krwotokach, trudnościach menstruacyjnych i żółtaczce. Kurkumina jest składnikiem wielu leków, m.in Solarenu (wyciąg alkoholowy), Cholegranu i in., stosowanych w stanach uszkodzenia i niewydolności wątroby, objawiających się w niedostatecznym wydzielaniu żółci (po doustnym podaniu kurkuminy produkcja kwasów żółciowych wzrasta ponad 100%); również w stanach zapalnych miąższu wątroby i dróg żółciowych. Właściwości ochronne i przeciwnowotworowe kurkuminy zostały sprawdzone w różnych eksperymentach in vitro, a także na zwierzętach laboratoryjnych.
WŁAŚCIWOŚCI PRZECIWZAPALNE I PRZECIWNOWOTWOROWE KURKUMINY Jedną z najczęściej badanych ochronnych właściwości kurkuminy jest mechanizm leżący u podstaw przeciwzapalnego i przeciwnowotworowego działania tej substancji. Taką spektakularną demonstracją tych własności jest ochronne działanie w przypadku ekspozycji na chemiczne środki rakotwórcze. Miejscowe zaaplikowanie kurkuminy silnie hamuje indukowany TPA(tkankowy antygen polipeptydowy) stan zapalny, hiperplazję, proliferację, aktywność dekarboksylazy ornityny (ODC), powstawanie reaktywnych form tlenu, powstawanie uszkodzonych (utlenionych) zasad w DNA, ekspresji mRNA ODC, a także powstawanie brodawczaków (papilloma) na skórze myszy.
Istnieją również doniesienia, że kurkumina hamuje aktywność cyklooksygenazy w mysich mikrosomach epidermalnych i lipoksygenazy w cytosolu, a także hamuje agregację płytek krwi indukowaną kwasem arachidonowym oraz wytwarzanie tromboksanu B2 z kwasu arachidonowego w płytkach krwi. Ekspozycja na kurkuminę wielu linii komórkowych pochodzenia żołądkowo-jelitowego hamuje zarówno ekspresję mRNA, jak i białka COX-2, a także produkcję prostaglandyny PGE2 indukowanej TPA lub chenodezoksycholanem. Wiązanie faktora transkrypcyjnego AP-1 do DNA, indukowane przez TPA lub chenodezoksycholan, może być również zahamowane przez kurkuminę. Podobnie, w komórkach epitelialnych okrężnicy kurkumina hamuje COX-2 wyzwoloną przez TNFa (czynnik martwiczy nowotworu; cytokina prozapalna) lub fekapentaen-12. Wydaje się, że hamowanie to odbywa się przez zablokowanie aktywacji faktora transkrypcyjnego NFKB na poziomie kompleksu NIK(NF-kB-inducing kinase) /IKK (IKB kinases). Kurkumina hamuje również syntezę NO oraz ekspresję białka i mRNA iNOS w makrofagach RAW 264.7 stymulowanych za pomocą LPSu (lipopolisacharyd, bakteryjna endotoksyna) lub interferonem g (IFNg). Hamowanie to jest przypisywane supresji aktywacji faktora transkrypcyjnego c-jun/AP-1. Faktor transkrypcyjny AP-1 stanowi kompleks białka c-jun i c-fos. Ekspozycja mysich fibroblastów NIH3T3 na TPA stymuluje ekspresję obu genów c-jun i c-fos w tych komórkach. Jak wspomniano wcześniej kurkumina hamuje syntezę c-jun, jednak w tych samych warunkach eksperymentalnych związek ten nie hamował syntezy mRNA c-fos. W przeciwieństwie do tego kurkumina w dawce 10 mmoli prawie całkowicie hamowała ekspresję mRNA c-fos i c-jun indukowaną za pomocą TPA w skórze myszy, co prawdopodobnie jest głównym powodem jej właściwości przeciwnowotworowych. Jak widać w różnych komórkach istnieją różnice w przekazywaniu sygnałów. Jak wspomniano wyżej, oprócz AP-1, główny mediator stanu zapalnego – NFKB, wydaje się być również docelowym miejscem plejotropowego działania kurkuminy. Kurkumina blokuje degradację IKB (inhibitor KB, ochronnego białka, które utrzymuje NFKB w cytosolu), a także następną translokację faktora NFKB do jądra w endotelialnych komórkach aorty wołu. Kurkumina nie tylko znosi fosforylację i degradację IKB, indukowaną przez TNFa, ale również blokuje translokację do jądra p65, funkcjonalnie aktywnej podjednostki NFKB. Podobnie do TNFa, inna prozapalna cytokina interleukina-lb (IL-lb), aktywuje faktor NFKB. Również w tym przypadku kurkumina hamuje aktywację tego faktora przez zahamowanie fosforylacji, a następnie degradację IKB i translokację do jądra uwolnionego NFKB. Oprócz tego kurkumina hamuje aktywność kinazy białkowej C (PKC) indukowanej przez TPA w komórkach NIH3T3. Kurkumina wykazuje aktywność antyproliferacyjną lub indukującą apoptozę w wielu różnych nowotworowych liniach komórkowych. Pamiętać jednak należy, że skuteczność kurkuminy (podobnie jak innych leków przeciwzapalnych, w tym koksybów (np. Celebrex i Vioxx) w leczeniu nowotworów może zależeć od uwarunkowań danego przypadku, takich jak predyspozycji genetycznej, rodzaju, tkanki, stadium zaawansowania i innych. INNE WŁAŚCIWOŚCI Obok wyżej wspomnianych właściwości, kurkumina obniża poziom cukru we krwi w modelowych doświadczeniach na szczurach, w których indukowano cukrzycę za pomocą alloksanu. Podobnie kurkumina obniżała poziom cholesterolu, łagodziła uszkodzenia nerek i poprawiała gojenie ran u myszy i szczurów, u których indukowano cukrzycę za pomocą streptozotocyny. FARMAKOKINETYKA Kurkumina jest słabo przyswajalna przy stosowaniu doustnym. Jest daleko bardziej aktywna przy stosowaniu pozajelitowym. Badania na zwierzętach wykazały, że kurkumina przechodzi przez przewód pokarmowy w większości niezmieniona. Ta część, która zostaje, jest aktywnie metabolizowana przez śluzówkę jelita, a także wątrobę. Tylko ślady przedostają się do krwi przy doustnym podaniu nawet 2 g ludziom i większych dawek zwierzętom doświadczalnym. Absorpcja kurkuminy przy podaniu doustnym może być zwiększona przez jednoczesne podanie piperyny (związku izolowanego z pieprzu czarnego). Wykazano, że piperyna zwiększa dostępność podanej doustnie kurkuminy 2000 razy bez skutków ubocznych) (ryc. 5). Na podstawie obserwacji klinicznych zalecana dawka kurkuminy wynosi 400-600 mg, trzy razy dziennie.
Źródło
Borgis – Postępy Fitoterapii 2/2004, s. 87-90 Jacek M. Jankowski
NF-κB i AP-1 to dwa czynniki transkrypcyjne ściśle zaangażowane w szlaki komórkowe prowadzące do nowotworzenia. Jak omówiono wcześniej, ekspresja NF-κB jest indukowana przez różne stresujące bodźce (w tym stres oksydacyjny, cytokiny, takie jak TNF-α i IL-1, promieniowanie UV i antygeny zakaźne) i skutkuje ekspresją genów zaangażowanych w zapalenie i proliferację komórek. AP-1 jest czynnikiem transkrypcyjnym składającym się z dimerów lub heterodimerów z rodzin białek Jun, Fos i ATF, który wiąże się w określonym miejscu DNA znanym jako elementy reagujące na TPA (TRE) zawierające sekwencję konsensusową 5′-TGAG/CTCA- 3′. AP-1 jest również aktywowany w odpowiedzi na promotory nowotworowe, prozapalne cytokiny, promieniowanie UV i stres oksydacyjny. Wykazano, że aktywacja obu czynników transkrypcyjnych jest wymagana do utrzymania transformowanych fenotypów onkogennych w mysich epidermalnych komórkach JB6 . Podobnie jak NF-κB, AP-1 reguluje ekspresję różnych genów zaangażowanych w kontrolę cyklu komórkowego i apoptozę. Domena c-Jun AP-1 jest pozytywnym regulatorem ekspresji cykliny D1, przyczyniającym się do indukcji fenotypu rakotwórczego. c-Jun jest również negatywnym regulatorem ekspresji p53, a komórki fibroblastów stymulując wytwarzanie c-Jun oraz obniżają zarówno p53, jak i regulowanego przez p53 inhibitora kinazy zależnej od cyklin p21Cip1 / Waf1 i nie ulegają zatrzymaniu wzrostu po ekspozycji na promieniowanie UV . Ponadto wykazano, że c-Jun zmniejsza ekspresję p16 i antagonizuje aktywację p16 za pośrednictwem JunB . Kurkumina ma działanie hamujące zarówno na aktywację NF-κB, jak i AP-1. Jak opisano powyżej, wpływ kurkuminy na NF-κB jest mediowany przez hamowanie IκK i powoduje, że nieaktywny NF-κB pozostaje związany z IκBα w cytoplazmie.
W rezultacie wykazano, że kurkumina hamuje ekspresję różnych produktów genów regulowanych przez NF-κB zaangażowanych w karcynogenezę i wzrost guza, w tym cykliny D1, VEGF, COX-2, c-myc, Bcl-2, ICAM-1 i MMP-9 . W przypadku AP-1 wykazano, że kurkumina zmniejsza wytwarzanie mRNA c-jun in vivo. Tak więc proponuje się, że zmniejszona produkcja kompleksu Jun-Fos jest mechanizmem leżącym u podstaw zmniejszonej aktywności transkrypcyjnej AP-1 w obecności kurkuminy i w przeciwieństwie do innych inhibitorów Ap-1, efekt ten jest niezależny od statusu redoks cela. Wpływ na regulację cyklu komórkowego i apoptozę.
Wzrost i proliferacja komórek jest wysoce regulowanym zdarzeniem w normalnych komórkach, a zaburzenia cyklu komórkowego mogą prowadzić do niekontrolowanej proliferacji i przyczyniać się do złośliwego fenotypu komórek nowotworowych. Cykl komórkowy ssaków składa się z czterech głównych etapów: G1, S, G2 i M, przy czym G1 i G2 są określane jako fazy „przerwy” między zdarzeniami odpowiednio syntezy DNA i mitozy.
Ponadto istnieje piąta faza, określana jako G0, która reprezentuje stan spoczynku poza cyklem komórkowym, w którym komórki nie dzielą się aktywnie ani nie przygotowują do podziału. Kontrolę cyklu komórkowego uzyskuje się poprzez skoordynowaną interakcję cyklin z ich odpowiednimi kinazami zależnymi od cyklin (CDK) w celu utworzenia aktywnych kompleksów i wprowadzenia komórek do następnej fazy w odpowiednim czasie. Regulacyjna kontrola punktów kontrolnych odbywa się za pośrednictwem genu supresorowego nowotworu p53 i służy do monitorowania dokładności zdarzeń życiowych, takich jak replikacja DNA i segregacja chromosomów, i może skutkować zatrzymaniem cyklu komórkowego w celu umożliwienia naprawy w przypadku wykrycia nieprawidłowości

Zaburzenia regulacji regulacyjnej cyklu komórkowego mogą powodować powstawanie komórek nowotworowych, w których wzrost i proliferacja przebiegają w sposób niekontrolowany. Jednym z takich przykładów jest nadekspresja cykliny D1, którą obserwowano w wielu typach nowotworów, w tym w nowotworach hematologicznych i różnych guzach litych . Wykazano, że kurkumina hamuje ekspresję cykliny D1 w wielu typach raka, w tym w raku głowy i szyi, okrężnicy, pęcherza moczowego, piersi, szyjki macicy i trzustki, efekt przypisywany hamowaniu przez kurkuminę aktywacji NF-κB, a następnie supresji dalszych produktów genowych. Istnieją dwa główne szlaki apoptotyczne: szlak wewnętrzny (mitochondrialny) i szlak zewnętrzny (receptor śmierci). Ścieżka wewnętrzna obejmuje działanie p53 jako czynnika transkrypcyjnego w celu zwiększenia ekspresji Bax . Bax jest białkiem proapoptotycznym, które antagonizuje Bcl-2, białko antyapoptotyczne obecne w błonie mitochondrialnej. Gdy stosunek Bax/Bcl-2 wzrasta, ochronne działanie Bcl-2 na błonę mitochondrialną zostaje zakłócone, a przepuszczalność wzrasta, umożliwiając przeciek cytochromu c do cytozolu. Cytochrom c wiąże się z Apaf-1 (apoptotycznym czynnikiem aktywującym proteazę-1) tworząc kompleks apoptosomu, który inicjuje kaskadę kaspazy poprzez aktywację kaspazy-9 i powoduje śmierć komórki poprzez enzymatyczną destrukcję białek cytoplazmatycznych i DNA. Wykazano, że kurkumina selektywnie indukuje apoptozę w komórkach nowotworowych w fazie G2 poprzez regulację w górę ekspresji p53 i inicjację mitochondrialnego szlaku apoptotycznego poprzez zwiększoną ekspresję Bax i uwalnianie cytochromu c

Kurkumina ma również stymulujący wpływ na zewnętrzny szlak apoptotyczny, który jest wyzwalany przez wiązanie „aktywatorów śmierci”, takich jak TNF-α i Ligand Fas, z odpowiadającymi im receptorami na powierzchni komórki. Aktywacja tych receptorów skutkuje aktywacją kaspazy-8 poprzez cząsteczkę adaptorową FADD przyłączoną do receptora i inicjacją kaskady kaspazy . Wykazano, że kurkumina zwiększa poziomy Fas i FADD oraz indukuje apoptozę w komórkach zwojowych siatkówki myszy i szczura. Badanie w czerniaku wykazało, że kurkumina prowadziła do apoptozy poprzez promowanie agregacji receptorów Fas i zwiększenie poziomu kaspazy-8 i -3 bez zmiany poziomu kaspazy-9 (unikatowej dla szlaku wewnętrznego). Ponadto, hamowanie przez kurkuminę szlaku przeżycia komórek, w którym pośredniczy NF-κB, jest również ważne w proapoptotycznym działaniu związku.
Aktywność przeciwnowotworowa: tłumienie karcynogenezy Kurkumina była badana w wielu ludzkich rakach, w tym czerniaku, nowotworach głowy i szyi, piersi, okrężnicy, trzustki, prostaty i jajnika. Badania epidemiologiczne przypisują niską zachorowalność na raka jelita grubego w Indiach właściwościom chemoprewencyjnym i przeciwutleniającym diet bogatych w kurkuminę [97]. Mechanizmy, dzięki którym kurkumina wywiera swoje działanie przeciwnowotworowe, są kompleksowe i różnorodne, ukierunkowane na wiele poziomów regulacji procesów wzrostu i apoptozy komórek. Oprócz pionowego wpływu kurkuminy na różne czynniki transkrypcyjne, onkogeny i białka sygnałowe, działa ona również na różnych etapach czasowych karcynogenezy —- od początkowych urazów prowadzących do mutacji DNA poprzez proces nowotworzenia, wzrostu i przerzutów. Ze względu na dalekosiężne efekty i liczne cele działania kurkuminy na procesy regulujące wzrost komórek, jest ona bardzo obiecująca jako potencjalny środek chemioterapeutyczny w przypadku wielu ludzkich nowotworów.

Źródło: Curcumin: A review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma
.
