Olejek CBD
Nasz produkt -Olejek CBD a w zasadzie ekstrakt z kwiatów konopi to substancje oleiste o wysokiej temperaturze wrzenia otrzymywane przez ekstrakcję rozpuszczalnikową. Dobór odpowiedniego rozpuszczalnika stanowi o jakości produktu, zawartości cennych
inne: CBG, CBC, CBN, THC oraz ponad 120 rodzajów terpenów ( więcej o tym w “baza wiedzy”). Fakt ten jest o tyle istotny, iż substancje czynne konopi oddziałują na receptory kannabinoidowe w naszym organizmie a literatura fachowa podaje, iż najlepsze efekty terapetyczne uzyskuje się przez stosowanie kompletnych ekstraktów względem izolowanych związków jak np. CBD. Nasze olejki są przebadane i posiadają odpowiednie certyfikaty, konsultując sie z laboratorium badawczym, w którym wykonujemy analizy naszych produktów wiemy, że stosowane przez nas metody rozpuszczalnikowe są znacznie efektywniejsze niż np. ekstrakcja CO2 w stanie nadkrytycznym..Metodą ekstrakcji jest ekstrakcja rozpuszczalnikowa co pozwala na wydobycie z roślin maksymalnie najwięcej związków z rodziny kannabinoidów oraz współobecnych: witaminy D ( kalcyferol)flawonoidów i terpenów, których liczba sięga nawet 120 .
Te ostatnie związki nadają ekstraktowi charakterystyczny ciemnozielony kolor, intensywny zapach i gorzki smak. To właśnie na terpenoidach w całym świecie roślin ( kurkuma, czarnuszka, glistnik, rumianek, krwawnik, łopian, mniszek lekarski i setki innych) oparte są mechanizmy działania antybakteryjnego, antywirusowego, przeciwhistaminowego, przeciwnowotworowego, przeciwgrzybiczego i wielu innych.
Terpenoidy są związkami o wysokiej temperaturze wrzenie ( ponad 200 stopni Celsjusza) dlatego też konsystencją przypominają smary, z tego też powodu nasz olejek cbd 10%powstaje przez rozcieńczenie pasty olejem z oliwek tak aby użytkownik mógł korzystać z zakraplacza.
Na rynku istnieją alternatywne ( tańsze) metody ekstrakcji i przygotowania olejków CBD. Charakteryzują się one klarownością i słomkowym kolorem. Mimo wysokiej zawartości CBD inne kannabinoidy ( o nich mowa poniżej) występują w znacznie niższych stężeniach. Popularność CBD wynika głównie z najlepszego przebadania tego związku i wykazania jego działań terapeutycznych jednak jak się okazuje kannabinoidy mogą się sprzęgać w oddziaływaniach i ulegać między sobą reakcjom biosyntezy. Ekstrakcja CO2 w stanie nadkrytycznym w bardzo małym stopniu wydobywa tak ważne wspomniane wcześniej terpeny. Z tego powodu oddajemy w Wasze ręce optymalny ekstrakt roślinny, w którym równowaga biochemiczna nie została zaburzona. Najgorszym w naszej ocenie rozwiązaniem jest stosowanie izolatów czyli olejków produkowanych na bazie zakupionych kryształów CBD i rozpuszczonych w tłuszczach do pożądanej procentowości. Proceder taki w naszym mniemaniu jest swojego rodzaju sterylizacją produktów konopnych.
Wspomniana pasta stanowi swoisty koncentrat do różnych rozcieńczeń w zależności od potrzeb stosowania. Jeśli zdarzy się, że pod wpływem przechowywania olejku cbd 10% w chłodnym miejscu dojdzie do powstania gęstej zawiesiny można z powodzeniem podgrzać buteleczkę w mocno ciepłej wodzie tak by konsystencja ponownie umożliwiła zakraplanie.
Dlaczego oliwa z oliwek a nie olej z nasion konopi jako rozcieńczalnik? Odpowiedź jest bardzo istotna – trwałość oleju. Jest to niezwykle ważny parametr zarówno jeśli chodzi o bezpieczeństwo samego oleju stanowiącego rozcieńczalnik a także substancji, które roztwarza. Trzeba nam wiedzieć, że oleje roślinne ( nienasycone) zawierają podwójne wiązania, które mogą pękać np. pod wpływem świtała uv lub slinego podgrzania bądź przez dłuższy kontakt z tlenem atmosferycznym. Dochodzi wtedy do zjawiska peroksydacji lipidów, czyli utlenienia prowadzącego do powstania w miejscu podwójnych wiązań rodników a więc bardzo reaktywnych indywiduów chemicznych mogących uszkadzać kwasy nukleinowe takie jak DNA lub RNA prowadząc do zmian nowotworowych. Same związki obecne w ekstrakcie( kannabinoidy, terpeny)również będą ulegać tym reakcjom Dodatkowo obecność podwójnych wiązań w olejach roślinnych stabilizuje te rodniki czyniąc je trwałymi i szczególnie niebezpiecznymi. To dlatego po smażeniu powinniśmy wymieniać olej a w przypadku olejów: z nasion konopi, z czarnuszki, z nasion lnu stosować tylko te tłoczone na zimno i przechowywać szczelnie zamknięte przez krótki okres czasu gdyż te ostatnie są bardzo podatne na utlenianie podwójnych wiązań a więc nietrwałe.
DZIAŁANIE TEREPAUTYCZNE
OLEJEK CBD DZIAŁANIE
Do udokumentowanych działań terapeutycznych kannabinoidów należą:
- analgezja (działanie przeciwbólowe) o sile i mechanizmie działania takich związków oddziałujących na receptory opioidowe jak morfina,
- przeciwwymiotne, uspokajające , usypiające ( regeneracja neuronów),
- regulacja pobudzającej i hamującej transmisji synaptycznej w ośrodkowym układzie nerwowym (OUN), przyjmowanie pokarmu, immunomodulacja (stymulowanie układu odpornościowego) ,
- działanie przeciwzapalne (obniżenie poziomu prozapalnych interleukin),
- działanie przeciwnowotworowe polegające na indukcji apoptozy, działaniu cytotoksycznym względem komórek rakowych, obniżeniu proliferacji komórek i zahamowaniu angiogenezy czyli rozrastaniu się naczyń krwionośnych w kierunku guza. Wykazano w toku wielu badań i w literaturze fachowej działanie przeciwnowotworowe CBD na komórki raka sutka, komórki glejaka, komórki raka prostaty , komórki raka trzustki.
Należy mieć na uwadze, że kannabinoidy w postaci ekstraktu olejowego wchłaniają się
maceutycznym a olejki prezentowane w sklepie nie są wyrobami medycznymi, nie są zatem przeznaczone do spożywania. Mniemając jednak o ogromnej odpowiedzialności i świadomości naszych klientów ufamy, że będą oni potrafili obejść się z produktem w sposób właściwy.
Działanie terapeutyczne przeciwnowotworowe
Wiele badań rozszerzyło koncepcję, że stan zapalny jest krytycznym elementem progresji nowotworu. Rzeczywiście, kilka nowotworów wywodzi się z infekcji, przewlekłego podrażnienia i zapalenia . Mikrośrodowisko guza, które jest w dużej mierze regulowane przez komórki zapalne, odgrywa kluczową rolę w procesie nowotworowym, sprzyjając proliferacji, przeżyciu i migracji. Ponadto komórki nowotworowe dokooptowały niektóre cząsteczki sygnalizacyjne wrodzonego układu odpornościowego do inwazji, migracji i przerzutów. Skupiając uwagę na niepsychoaktywnych kannabinoidach z konopi, wykazano, że CBD jest przydatne w leczeniu różnych dolegliwości zapalnych, w tym chorób jelit (np. choroba Crohna i wrzodziejące zapalenie jelita grubego), chorób neuronalnych (np. Parkinson i Alzheimer) oraz szerokiego zakresu chorób zapalnych skóry (np. atopowe zapalenie skóry i łuszczyca). W odniesieniu do nowotworów, CBD wykazuje działanie antyproliferacyjne i proapoptotyczne, wykazując tym samym modulowanie nowotworzenia w różnych typach raka, w tym raka piersi, płuc, okrężnicy, mózgu i innych.
Baza wiedzy o kannabinoidach
W dziale tym znajdziecie Państwo szczegółowe informacje z zakresu historii, botaniki i mechanizmów działania terapeutycznego kannabinoidów, polecany specjalistom i amatorom badań z zakresu fitoterapii.
Trudno wyobrazić sobie temat medyczny, który tak mocno dzieli społeczność naukową, jak lecznicze użycie konopi indyjskich. Można prawdopodobnie powiedzieć, że konopie to najbardziej kontrowersyjna roślina w historii ludzkości. Ale z pewnością, gdyby roślina Cannabis sativa została dziś odkryta, rosnąca w jakimś odległym zakątku świata, zostałaby okrzyknięta cudem natury; nowa cudowna roślina, która może leczyć wszystko, od bólów głowy po zaburzenia neurologiczne i raka. Dlatego warto zauważyć, że nawet po dziesięcioleciach badań konopie indyjskie są prawdopodobnie najbardziej znane z wywoływania niepokoju, pobudzenia i paranoi wśród polityków, podczas gdy ich potencjał leczniczy jest nadal kwestionowany. Co ciekawe, delta-9-tetrahydrokannabinol (THC), główny składnik konopi indyjskich i jeden z najbardziej znanych związków roślinnych na świecie, jest już uznawany za lek. Jest dostępny dla pacjentów od 1986 roku pod nazwą Marinol®, który jest przepisywany w leczeniu nudności, bólu i utraty apetytu. Więc nawet jeśli marihuana była niczym więcej niż ziołowym zbiornikiem THC, powinna być przynajmniej zaakceptowana jako generyczna forma tego zarejestrowanego leku. Jednak na wielu poziomach (in vivo, in vitro, w badaniach klinicznych) staje się coraz bardziej jasne, że samo THC nie równa się marihuanie [Williamson 2000; Russo 2003], wskazując, że inne składniki są niezbędne do wyjaśnienia deklarowanych efektów leczniczych. Konopie indyjskie mają potencjał, aby przekształcić się w przydatne i bardzo potrzebne lekarstwo, ale są poważnie utrudnione przez klasyfikację jako niebezpieczny narkotyk. Jednak, jak pokazano w przypadku rośliny opium (Papaver somniferum) i pochodnych od niej opiatów (np. Morfina, kodeina), rozróżnienie między niebezpiecznym narkotykiem odurzającym a lekiem można dokonać poprzez właściwe, obiektywne i dobrze przeprowadzone badania. . Miejmy nadzieję, że ta teza może przyczynić się do bardziej racjonalnego podejścia do konopi jako leku. 1.2 Konopie indyjskie i ich składniki 1.2.1 Formy konopi Obecnie marihuana, obok kawy i tytoniu, jest najczęściej używanym narkotykiem psychoaktywnym na świecie i jest jednym z najpopularniejszych nielegalnych narkotyków. Na całym świecie ponad 160 milionów ludzi regularnie używa konopi indyjskich, a liczby te wciąż rosną [World Drug Report, 2006]. Ale czym właściwie jest marihuana? Przy tak dużym popycie nie jest zaskakujące, że marihuana i jej produkty są znane pod wieloma różnymi nazwami. Poniżej zdefiniowano niektóre z najczęściej używanych. Powszechnie używany termin „marihuana” lub „marihuana” tradycyjnie opisuje konopie stosowane jako narkotyk rekreacyjny i często wiąże się z negatywnymi skutkami lub wpływem społecznym narkotyku. „Weed” to inna nazwa konopi indyjskich używanych jako narkotyk rekreacyjny. Kiedy używany jest termin „konopie”, zwykle odnosi się on do wykorzystania konopi indyjskich jako źródła błonnika, przez co termin „konopie włókniste” jest nieco zbędny. Z powodu niedokładny i nienaukowy charakter tych terminów, nie zostaną one użyte w niniejszej pracy. Zamiast tego właściwa nazwa naukowa „konopie indyjskie” będzie konsekwentnie używana do opisania rośliny Cannabis sativa L. we wszystkich jej odmianach. Mówiąc o konopiach do celów rekreacyjnych lub leczniczych, zwykle mówi się o kwiatach żeńskich („flos”), które są najsilniejszą częścią rośliny. Suszona żywica uzyskana z tych kwiatów jest ogólnie znana jako „haszysz” lub „haszysz”, chociaż istnieje wiele różnych nazw. Żywica ta jest źródłem najważniejszych bioaktywnych składników rośliny konopi indyjskich, „kannabinoidów”, które będą głównym tematem niniejszej rozprawy. Wreszcie „dronabinol” to inna nazwa naturalnie występującego (-) – trans-izomeru THC, często używana w kontekście medycznym w literaturze naukowej i politycznej i przyjęta przez Światową Organizację Zdrowia.
Botanika konopi
Podstawowym materiałem wszystkich produktów z konopi indyjskich jest roślina Cannabis sativa L (rys. 1.2). Jest to jednoroczne, zwykle dwupienne, bardziej reralie jednopienne, zapylane przez wiatr zioło, którego kwiaty męskie i żeńskie rozwijają się na osobnych roślinach. Rozmnaża się z nasion, rośnie energicznie w otwartych, słonecznych środowiskach z dobrze przepuszczalną glebą i ma duże zapotrzebowanie na składniki odżywcze i wodę. Może osiągnąć do 5 metrów (16 stóp) wysokości w okresie wegetacji trwającym od 4 do 6 miesięcy. Jednak we współczesnej hodowli i uprawie rekreacyjnej konopi preferowanym sposobem rozmnażania roślin jest klonowanie przy użyciu sadzonek tzw. „Rośliny matecznej”. Jak wskazuje to określenie, do tego celu wykorzystuje się rośliny żeńskie, które wytwarzają znacznie większe ilości związków psychoaktywnych niż rośliny męskie. Płeć konopi jest anatomicznie nie do rozróżnienia, zanim zaczną kwitnąć, ale później rozwój roślin męskich i żeńskich znacznie się różni (rysunek 1.3). Krótsze dni (a dokładniej dłuższe noce) powodują, że roślina zaczyna kwitnąć [Clarke, 1981]. Żeńska roślina następnie wytwarza kilka zatłoczonych skupisk pojedynczych kwiatów (kwiatostanów); jeden duży na szczycie łodygi i kilka mniejszych na każdej gałęzi, podczas gdy kwiaty męskie zwisają luźnymi gronami wzdłuż względnie bezlistnej, wyprostowanej gałęzi. Męskie rośliny kończą wyrzucać pyłek. Rysunek 1.1: Marihuana, „zabójca młodości”. Assassin of Youth (1937) to film sprzed II wojny światowej o negatywnych skutkach marihuany, odzwierciedlający histeryczną propagandę antynarkotykową tamtych czasów. Rozdział 1 4 i umierają, zanim nasiona roślin żeńskich dojrzeją cztery do ośmiu tygodni po zapłodnieniu. Duża samica może wyprodukować ponad kilogram nasion. Jeśli nasiono przeżyje, może wykiełkować następnej wiosny.
Zgodnie z aktualną klasyfikacją botaniczną konopie indyjskie należą wraz z chmielem (chmielem) do rodziny Cannabinaceae (także Cannabaceae i Cannabidaceae [Frohne, 1973; Turner, 1980; Schultes, 1980]. Pomimo tego związku kannabinoidy można znaleźć tylko w Cannabis sativa. W rodzaju Humulus, a także w eksperymentach rzemieślniczych między konopiami i Humulusami nie znaleziono kannabinoidów [Crombie, 1975; Fenselau, 1976].
The current systematic classification of Cannabis is [Lehmann, 1995]:
- Division Angiosperms
- Class Dicotyledon Subclass
- Archichlamydeae
- Order Urticales
- Family Cannabinaceae
- GenusCannabis
- Species sativa L
W wyniku wielowiekowej hodowli i selekcji rozwinęła się duża różnorodność odmian uprawnych (lub kultywarów). Ostatnio opisano ponad 700 różnych odmian [Snoeijer, 2001] i uważa się, że istnieje wiele innych. W rezultacie odbyła się obszerna dyskusja na temat dalszej klasyfikacji botanicznej i chemotaksonomicznej. Do tej pory zaproponowano kilka klasyfikacji konopi: klasyfikację Cannabis sativa L., C. indica LAM. i C. ruderalis JANISCH [Schultes, 1974; Anderson, 1974; Emboden, 1974] lub Cannabis sativa L. ssp. Sativa i ssp. Indica [Small, 1976a, b; Cronquist, 1981]. Jednak powszechnie przyjmuje się, że konopie indyjskie są monotypowe i składają się tylko z jednego gatunku Cannabis sativa, jak opisał Leonard Fuchs w XVI wieku [Beutler, 1978; Lawi-Berger, 1982a, b; Brenneisen, 1983]. Aby rozwiązać spór w sposób biochemiczny, Grlic [1968] dokonał pierwszej klasyfikacji chemicznej, który rozpoznał różne etapy dojrzewania. Fettermann [1971b] opisał różne fenotypy na podstawie ilościowych różnic w zawartości głównych kannabinoidów i jako pierwszy rozróżnił rodzaj leku i błonnika. Dalszego rozszerzenia i udoskonalenia tego podejścia dokonali następnie Small i Beckstead [1973], Turner [1979] i Brenneisen [1987]. Stwierdzono, że pojedynczą roślinę można podzielić na różne fenotypy w zależności od wieku. Chociaż te klasyfikacje chemotaksonomiczne nie definiują ściśle zawartości głównych kannabinoidów dla każdego chemotypu, stanowią praktyczne narzędzie klasyfikacji. Ostateczna walidacja klasyfikacji konopi oczekuje na dalsze badania chemotaksonomiczne i genetyczne. Do celów kryminalistycznych i legislacyjnych najważniejszą klasyfikacją rodzajów konopi jest podział na rodzaj błonnika i rodzaj narkotyku. Główna różnica między tymi dwoma polega na zawartości psychotropowo aktywnego składnika Δ9-tetrahydrokanabinolu (THC): wysoka zawartość THC klasyfikuje się jako konopie narkotykowe, podczas gdy niska zawartość THC występuje w konopiach włóknistych. Wszystkie odmiany konopi stosowane obecnie w celach leczniczych należą do typu narkotyków ze względu na wysoką zawartość biologicznie aktywnego THC. Ale chociaż typu włókna .Konopie indyjskie nie są powszechnie używane do celów leczniczych lub rekreacyjnych, zawierają składniki, które uznano za aktywne biologicznie, co wskazuje, że rozróżnienie między tymi dwoma rodzajami ma ograniczone znaczenie dla badań medycznych nad konopiami indyjskimi.

Konopie najprawdopodobniej pochodzą z Azji Środkowej, ponieważ dowody archeologiczne wskazują, że były uprawiane w Chinach w celach spożywczych i błonnika już 10.000 lat temu. Również w starożytnych mumiach egipskich znaleziono wskazówki dotyczące używania konopi jako pożywienia lub leku [Balabanova, 1992]. W rzeczywistości marihuana jest jedną z najstarszych znanych roślin leczniczych i jest opisywana w prawie każdym starożytnym podręczniku medycyny roślinnej, najczęściej w postaci nalewki lub herbaty [Zuardi, 2006; Grotenhermen, 2002]. Niektóre religie były ściśle związane z właściwościami rośliny konopi. Na przykład w hinduskiej legendzie uważa się, że konopie indyjskie są ulubionym pożywieniem boga Shivy ze względu na swoje energetyzujące właściwości. Gdy marihuana rozprzestrzeniła się z Azji na Zachód, prawie każda kultura miała kontakt z tą cudowną rośliną. Obecnie konopie można znaleźć we wszystkich strefach umiarkowanych i tropikalnych, z wyjątkiem wilgotnych, tropikalnych lasów deszczowych [Conert, 1992]. Jako roślina włóknista konopie indyjskie wytwarzają jedne z najlepszych i najtrwalszych włókien pochodzenia naturalnego. Przez długi czas w historii włókna te były używane do produkcji żagli do statków morskich, papieru, banknotów, a nawet pierwszych dżinsów Levi’s. Sugeruje się, że olej z nasion konopi jest dobrze zbilansowany pod względem stosunku kwasu linolowego i linolenowego w żywieniu ludzi. Ponadto olej ze względu na tę właściwość oraz obecność kwasu gamma-linolenowego jest idealny jako składnik olejków do ciała i kremów wzbogaconych w lipidy [Oomah, 2002]. Pomimo faktu, że konopie indyjskie były uprawiane na dużą skalę w większości krajów, nadużywanie ich jako narkotyku pozostawało rzadkością w Europie i Stanach Zjednoczonych do stosunkowo niedawna. Ludzie byli w dużej mierze nieświadomi psychoaktywnych właściwości konopi indyjskich i jest mało prawdopodobne, aby wczesne odmiany, wyselekcjonowane głównie ze względu na właściwości błonnika, zawierały znaczne ilości psychoaktywnego związku THC. Zastosowanie lecznicze konopi indyjskich zostało wprowadzone w Europie dopiero około 1840 r. Przez młodego irlandzkiego lekarza Williama O’Shaughnessy, który służył dla East India Trading Company w Indiach, gdzie stosowanie marihuany do celów leczniczych było szeroko rozpowszechnione. W przeciwieństwie do europejskich konopi włóknistych, te indyjskie odmiany zawierały rozsądną ilość związków bioaktywnych. W następnych dziesięcioleciach marihuana przez krótki okres cieszyła się popularnością zarówno w Europie, jak iw Stanach Zjednoczonych. U szczytu popularności dostępnych było ponad 28 różnych preparatów leczniczych zawierających konopie indyjskie jako substancję czynną, które były zalecane w tak różnych wskazaniach, jak skurcze menstruacyjne, astma, kaszel, bezsenność, wspomaganie porodu, migrena, infekcje gardła i odstawienie od używanie opium [Grotenhermen, 2002]. Jednak trudności z dostawami z zagranicy izróżnicowana jakość materiału roślinnego utrudniała przygotowanie niezawodnej receptury konopi. Ponieważ nie istniały żadne narzędzia do kontroli jakości, niemożliwe było przygotowanie znormalizowanego leku, więc pacjenci często otrzymywali dawkę, która była albo zbyt mała, bez efektu, albo zbyt wysoka, co powodowało poważne skutki uboczne. Ponadto ekstrakt z konopi nie był rozpuszczalny w wodzie i nie można go było wstrzykiwać, podczas gdy podawanie doustne okazało się zawodne ze względu na powolne i nieregularne wchłanianie. Z powodu tych niedogodności medyczne stosowanie konopi indyjskich coraz bardziej zanikło na początku XX wieku. Kiedy ostatecznie nałożono wysoki podatek na wszystkie produkty na bazie konopi indyjskich (z wyłączeniem nasion i błonnika) i wprowadzono coraz bardziej restrykcyjne przepisy dotyczące nadużywania konopi indyjskich, medyczne użycie konopi stopniowo zniknęło ze wszystkich zachodnich farmakopei w okresie od 1937 r. [Grotenhermen i Russo, 2002]. W przeciwieństwie do alkaloidów kodeiny i morfiny, które są pochodnymi opium, izolacja czystych substancji czynnych z konopi została osiągnięta dopiero w latach sześćdziesiątych XX wieku [Gaoni, 1964a]. Dopiero od rozkwitu lat sześćdziesiątych XX wieku palenie konopi indyjskich jako narkotyku rekreacyjnego stało się szeroko znanym zjawiskiem w zachodnim świecie. Od tego czasu import silniejszych odmian z tropików, w połączeniu z rosnącym zainteresowaniem hodowlą, początkowo przede wszystkim wśród weteranów wojny w Wietnamie, doprowadził do stałego wzrostu siły psychoaktywnej. Współczesne konopie rekreacyjne w coraz większym stopniu stają się uprawą high-tech, uprawianą w pomieszczeniach zamkniętych w całkowicie sztucznych warunkach.
Składniki konopi
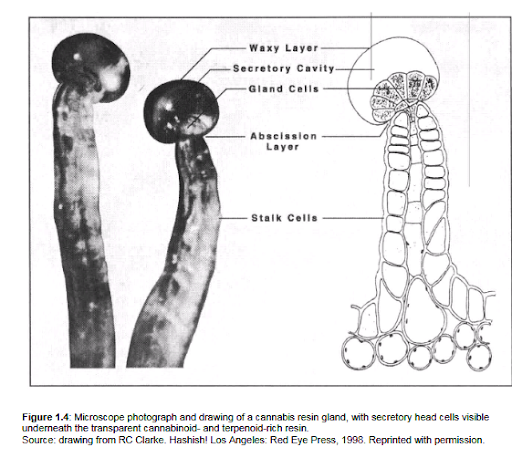
Dzięki ponad 420 znanym składnikom, konopie indyjskie są jedną z najlepiej przebadanych chemicznie roślin [Turner, 1980; Ross, 1995]. Najbardziej interesującym spośród tych składników jest wydzielina komórek głowy włosków gruczołowych (trichomów) rozmieszczona na powierzchni rośliny konopi (rysunek 1.4). Chociaż włosie można znaleźć na wszystkich roślinach męskich i żeńskich, są one szczególnie skoncentrowane w niektórych częściach kwiatostanu żeńskiego. Samotne gruczoły żywiczne, składające się z jednego lub dwóch tuzinów komórek, najczęściej tworzą się na końcach smukłych łodyg trichomów, które tworzą przedłużenie powierzchni rośliny. Gruczoły te wydzielają aromatyczną żywicę zawierającą terpenoidy o bardzo wysokiej zawartości kannabinoidów, która gromadzi się pod cienką woskową błoną otaczającą komórki wydzielnicze głowy. Wydzielana żywica jest w dużej mierze oddzielona od komórek wydzielniczych, co izoluje żywicę z atmosfery, a także enzymy związane z błoną, chroniąc ją przed degradacją oksydacyjną i zmianami enzymatycznymi. Warstwa komórek odciętych u podstawy każdej głowy wydzielniczej umożliwia łatwe usunięcie gruczołu [Kim, 2003]. Żywica wydalana przez trichomy zawiera różnorodne składniki, z których każdy może odgrywać rolę w biologicznej aktywności rośliny konopi. Wśród nich są terpenoidy, flawonoidy i kannabinoidy. Ponieważ badanie wszystkich tych elementów w ramach jednego projektu doktoranckiego byłoby zbyt skomplikowane, praca ta koncentruje się szczególnie na kannabinoidach. Miejmy nadzieję, że inne klasy związków otrzymają (ponownie) ich część naukowej uwagi w najbliższej przyszłości. Adaptacyjne znaczenie gruczołów żywicznych pozostaje spekulacyjne. Chociaż żywica zapewnia pewną ochronę przed atakiem owadów i grzybów, uprawy konopi są nadal podatne na atak wielu różnych szkodników, szczególnie w warunkach szklarniowych. Z pewnością odurzające działanie żywicy konopnej zwiększyło drapieżnictwo konopi indyjskich przez ludzi, a także zachęciło do jej udomowienia, a tym samym dramatycznie rozszerzyło jej dystrybucję. Ostatnio wykazano, że kannabinoidy, kwas kannabigerolowy (CBGA) i kwas tetrahydrokanabinolowy (THCA), indukują śmierć komórki poprzez apoptozę w komórkach roślinnych, ale także w komórkach owadów. Ponadto tworzenie THCA jest związane z tworzeniem się nadtlenku wodoru, który może przyczyniać się do samoobrony rośliny konopi [Sirikantaramas, 2005]. Wyniki te silnie sugerują, że kannabinoidy działają jako związki obronne roślin, podobnie jak wiele innych wtórnych metabolitów roślin. Dokonano obszernego przeglądu składników konopi indyjskich [Turner, 1980; Ross, 1995]. Oprócz co najmniej 66 kannabinoidów, związki zidentyfikowane w produktach z konopi indyjskich są wymienione w tabeli 1.1 [Grotenhermen, 2002].
120 terpenoidów 50 węglowodorów 34 cukry i związki pokrewne 27 związków azotowych 25 fenoli niekannabinoidowych 22 kwasy tłuszczowe 21 prostych kwasów 21 flawonoidów 18 aminokwasów 13 prostych ketonów 13 prostych estrów i laktonów 12 prostych aldehydów 11 białek, glikoprotein i enzymów 11 steroidów 9 elementów 7 proste alkohole 2 pigmenty 1 witamina.
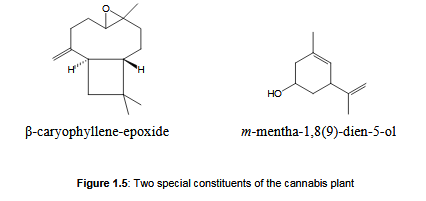
Jak dotąd w konopiach znaleziono ponad 100 terpenoidów, w tym 58 monoterpenoidów, 38 seskwiterpenoidów, jeden diterpenoid, dwa triterpenoidy i cztery inne terpenoidy [Turner, 1980]. Można je badać po destylacji parą wodną materiału z konopi indyjskich lub metodą chromatografii gazowej, chociaż między tymi dwiema technikami widoczne są duże różnice jakościowe [Hood, 1973; Strömberg, 1974; Hendriks, 1978]. Podczas gdy kannabinoidy są bezwonne, lotne mono- i seskwiterpenoidy są związkami, które nadają marihuanie wyraźny zapach. Na przykład seskwiterpenoid β-kariofilenu-epoksyd (rysunek 1.5) jest głównym związkiem, którego rozpoznawanie jest tresowane przez psy poszukiwawcze [Stahl, 1973]. W marihuanie można znaleźć tylko jeden niezwykły terpenoid: monoterpenoid m-mentha-1,8 (9) -dien-5-ol (ryc. 1.5). Wszystkie inne można znaleźć wszechobecnie w przyrodzie. Z tego powodu terpenoidy konopi nie cieszyły się dużym zainteresowaniem naukowym, dopóki nie stwierdzono, że spektrum terpenoidów produktów z konopi indyjskich może pomóc w określeniu pochodzenia konopi indyjskich w niestandardowych konfiskatach [Brenneisen, 1988].
Definicja kannabinoidów
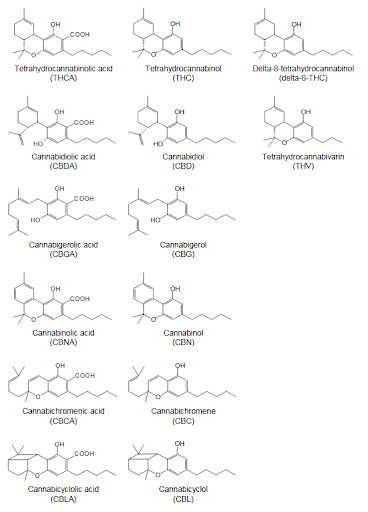
Kannabinoidy są uważane za główne biologicznie aktywne składniki konopi. Pomimo faktu, że THC jest często błędnie określane jako „składnik aktywny” preparatów z konopi indyjskich, obecnie opisano co najmniej 66 różnych kannabinoidów. Najważniejsze z nich przedstawiono na rysunku 1.6. Mechoulam i Gaoni [1967] zdefiniowali kannabinoidy jako: grupę związków C21 typowych i obecnych w Cannabis sativa, w tym ich kwasy karboksylowe, analogi i produkty przemiany. Jednak z tej raczej ograniczonej definicji farmakognostycznej wymagana jest obecnie znaczna ekspansja. Nowoczesna definicja położy większy nacisk na chemię syntetyczną i farmakologię, a także obejmie pokrewne struktury lub dowolny inny związek, który wpływa na receptory kannabinoidowe. To jednak tworzy kilka chemicznych podkategorii kannabinoidów. W tej pracy nacisk zostanie położony wyłącznie na (fito) kannabinoidy, naturalnie występujące w roślinie konopi. Pod względem chemicznym (fito) kannabinoidy należą do terpenofenoli, które są bardzo powszechne w przyrodzie. Kannabinoidy gromadzą się we włosach gruczołowych opisanych powyżej, gdzie zazwyczaj stanowią ponad 80% wydzieliny podskórnej. Ogólnie rzecz biorąc, wszystkie części roślin mogą zawierać kannabinoidy, z wyjątkiem nasion. Ślady kannabinoidów znalezione w nasionach są najprawdopodobniej wynikiem zanieczyszczenia żywicą konopi z kwiatów [Lawi-Berger, 1982; Ross, 2000]. Zasadniczo nie ma jakościowych różnic w widmie kannabinoidów między częściami roślin, a jedynie ilościowe różnice [Fetterman, 1971b; Field, 1980]. Najwyższe stężenia kannabinoidów (w% suchej masy materiału roślinnego) można znaleźć w przylistkach kwiatów i owoców. W liściach zawartość jest mniejsza, aw łodygach, a tym bardziej w korzeniach, zawartość jest bardzo niska [Hemphill, 1980]. Konopie uprawiane na zewnątrz mają zazwyczaj niższy poziom kannabinoidów w porównaniu z roślinami uprawianymi w pomieszczeniach. Przy uprawie w sztucznych warunkach o wysokiej wydajności można uzyskać części kwitnące konopi o zawartości żywicy do 25-30%, składającej się głównie z THC (w postaci jego kwaśnego prekursora THCA, patrz poniżej). Ta duża obfitość jednego rodzaju wtórnego metabolitu jest praktycznie niespotykana w królestwie roślin. Co ciekawe, THC, psychotropowo aktywny składnik konopi, nie zawiera atomu azotu i dlatego nie jest alkaloidem. Jest to rzadkie wśród związków aktywnych psychotropowo.
Biosynteza
Do numeracji chemicznej kannabinoidów stosowano dotychczas 5 różnych systemów nazewnictwa [Eddy, 1965], ale obecnie najczęściej stosowanym systemem jest numeracja dibenzopiranowa, która jest również stosowana przez Chemical Abstracts. W Europie szeroko stosowany jest także system monoterpenoidów oparty na p-cymenie. W rezultacie główny psychoaktywny kannabinoid delta-9-THC jest czasami opisywany jako delta-1-THC w starszych rękopisach. W niniejszej pracy konsekwentnie stosuje się numerację dibenzopiranową, dlatego THC jest w pełni opisywany jako (-) – trans-Δ9-tetrahydrokannabinol (ryc. 1.7).

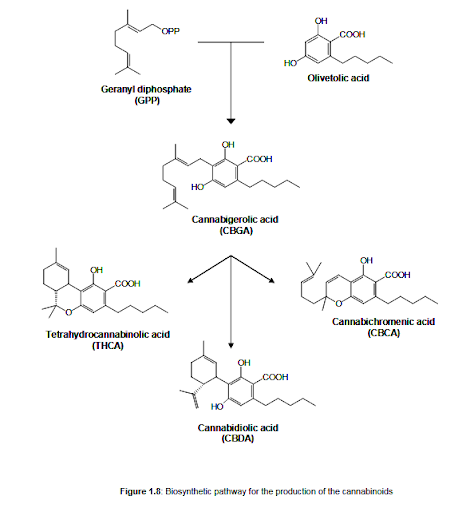
We wszystkich biosyntetycznych szlakach kannabinoidów, które postulowano do 1964 r., CBD lub CBDA były uważane za kluczowy związek pośredni, który został zbudowany odpowiednio z monoterpenu i oliwetolu lub kwasu oliwetolowego. Następnie z tego wspólnego prekursora wyprowadzono inne kannabinoidy. Jednak Gaoni i Mechoulam [1964b] wykazali, że CBG jest prekursorem CBD, który był biosyntetyzowany przez kondensację geranylopirofosforanu (GPP) i oliwetolu lub kwasu oliwetolowego. Następnie doszli do wniosku, że CBD, THC i CBN wszystkie wywodzą się z CBG i różnią się głównie sposobem cyklizacji tego prekursora [Mechoulam, 1965; 1967; 1970; 1973]. Shoyama [1970; 1975] ponadto stwierdził, że ani wolne formy fenolowe kannabinoidów, ani CBNA nie zostały wyprodukowane przez żywą roślinę. Zamiast tego postulował biosyntetyczny szlak oparty na geraniolu i poliketokwasie. Do tego samego wniosku doszli Turner i Hadley [1973] po zbadaniu afrykańskich odmian konopi. Ten szlak biosyntetyczny może wyjaśniać różne zawartości kannabinoidów w produktach z konopi indyjskich różnego pochodzenia oraz występowanie homologów i pochodnych. Obecnie szeroko akceptowana jest hipoteza, że reszta C10-terpenoidu jest biosyntetyzowana przez szlak fosforanu dezoksyksylulozy, a ugrupowanie fenolowe jest generowane przez sekwencję reakcji typu poliketydu. Dokładniej, badania włączania z glukozą znakowaną 13C w rozdziale 1 14 wykazały, że difosforan geranylu (GPP) i kwas oliwetolowy poliketydu są specyficznymi związkami pośrednimi w biosyntezie kannabinoidów, prowadząc do powstania CBGA (rysunek 1.8) [Fellermeier, 1998; Fellermeier, 2001]. Dalsze biosyntetyczne szlaki produkcji kannabinoidów stały się w końcu jasne dzięki identyfikacji, a następnie klonowaniu odpowiedzialnych genów [Taura, 1995b; Taura, 1996; Morimoto, 1998]. Główna zmienność strukturalna kannabinoidów występuje w alkilowym łańcuchu bocznym ugrupowania kwasu oliwetolowego: chociaż zazwyczaj występuje łańcuch pentylowy (C5), można również znaleźć krótsze łańcuchy boczne, od C4 do C1. Warto zauważyć, że wolny kwas oliwetolowy nigdy nie został wykryty w materiale roślinnym konopi.
W oparciu o ten szlak kannabinoidy są wytwarzane przez konopie indyjskie w postaci kwasów karboksylowych, w których podstawnikiem w pozycji 2 jest grupa karboksylowa (–COOH). W konsekwencji w świeżym materiale roślinnym prawie nie można znaleźć neutralnych kannabinoidów, ale teoretycznie wszystkie kannabinoidy występują w tej kwaśnej formie. Jednak grupa karboksylowa nie jest bardzo stabilna i łatwo jest uwalniana jako CO2 pod wpływem ciepła lub światła, w wyniku czego powstaje odpowiadający jej obojętny kannabinoid. W ten sposób kwaśny prekursor THCA może zostać przekształcony w psychoaktywny THC, co jest powodem, dla którego wszystkie formy (rekreacyjnego) spożycia konopi indyjskich obejmują jakąś formę podgrzewania materiału (np. Palenie, waporyzacja, robienie herbaty czy wypieków).
Klasyfikacje kannabinoidów
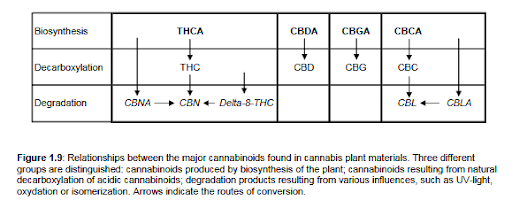
Chociaż znanych jest ponad 60 kannabinoidów, nie należy wyciągać wniosku, że wszystkie kannabinoidy są wykrywalne we wszystkich produktach z konopi indyjskich. Zostały zidentyfikowane przez kilkadziesiąt lat badań nad konopiami indyjskimi, badając wiele różnych produktów z konopi indyjskich oraz różne, a czasem rzadkie rodzaje roślin konopi indyjskich o różnym pochodzeniu i cechach. Główne typy kannabinoidów, które zwykle są wykrywane w każdym szczepie hodowlanym lub odmianie konopi, to THC, CBD, CBN, CBG i CBC. Jednak mogą istnieć ogromne różnice w ich stosunkach ilościowych. Różne chemiczne typy kannabinoidów zostały dobrze opisane [Turner, 1980, ElSohly 1983] i dlatego nie będą tutaj obszernie omawiane. Jednak zrozumienie, w jaki sposób kannabinoidy są (chemicznie) ze sobą powiązane, jest ważne podczas badania próbek konopi, ponieważ degradacja i zmiany w profilu kannabinoidów mogą wystąpić w wyniku warunków przechowywania lub hodowli, różnic w przygotowywaniu leków, mieszaniu z innymi składnikami. (np. tytoń podczas palenia), podgrzewanie itp. Dla prac fitochemicznych w tej pracy, kannabinoidy można najdogodniej podzielić na trzy grupy (patrz także rysunek 1.9):
- kannabinoidy obecne w roślinie powstałe w wyniku dekarboksylacji (neutralne kannabinoidy);
- kannabinoidy powstające jako artefakty w wyniku degradacji (np .: utlenianie, izomeryzacja, promieniowanie UV).
- kannabinoidy wytwarzane przez metabolizm rośliny (kannabinoidy kwaśne);
Na szczególną uwagę zasługuje grupa kannabinoidów, które powstają w wyniku warunków degradacyjnych, ponieważ ich obecność jest w dużej mierze wynikiem zmiennych i nieprzewidywalnych warunków na wszystkich etapach uprawy, zbioru, przetwarzania, przechowywania i użytkowania. W rezultacie dobrze zdefiniowany preparat z konopi indyjskich może szybko zmienić się w produkt o znacząco różnych skutkach biologicznych. W szczególności w próbkach, które były przechowywane przez dłuższy czas, CBN można znaleźć w stosunkowo dużych ilościach. Kannabinoidy typu CBN nie powstają w wyniku biosyntezy, ale raczej w wyniku utleniającej degradacji typów THC i CBD. Również typy Δ8-THC i CBL nie występują naturalnie, ale artefakty. Izomeryzacja ∆9- Rozdział 1 16THC do ∆8-THC jest dobrze udokumentowany [Mechoulam, 1970; Mechoulam, 1973; Razdan, 1973]. Ponieważ ∆8-THC jest bardziej termostabilny niż ∆9-THC, podczas ogrzewania będzie się kumulował ∆9-THC. Kannabinoid CBL powstaje w wyniku wystawienia CBC na promieniowanie UV, co prowadzi do usieciowania dwóch podwójnych wiązań w cząsteczce [Crombie, 1968].
Leki oparte na produktach naturalnych są zwykle trudne do zbadania. Materiały roślinne mogą zawierać wiele (strukturalnie) blisko spokrewnionych związków i często nie jest jasne, co to jest składnik aktywny, jeśli w rzeczywistości istnieje tylko jeden. Czasami biologicznie aktywne składniki rośliny zostały scharakteryzowane tylko częściowo (np. Ginkgo biloba, ziele dziurawca, Hypericum perforatum, Echinacea purpurea). Ze względu na złożoność roślin leczniczych, niektóre ważne warunki wiarygodnego badania produktów naturalnych to: dostępność metod analitycznych, które umożliwiają badanie składników bez degradacji próbki; wzorce odniesienia interesujących związków; oraz jasny przegląd właściwości fizykochemicznych, spektroskopowych i chromatograficznych składników próbki. W przypadku badania kannabinoidów dostępne metody analityczne zostały ostatnio szeroko przeanalizowane przez Raharjo [2004]. Zdecydowanie najczęściej stosowanymi metodami chromatograficznymi były wysokosprawna chromatografia cieczowa (HPLC) i chromatografia gazowa (GC). Zastosowanie GC, zwykle sprzężonego z detekcją płomieniowo-jonizacyjną (FID) lub detekcją masową (MS), pozwala na analizę dużej różnorodności kannabinoidów o bardzo wysokiej rozdzielczości. Jednak główną wadą GC jest fakt, że kwaśnych kannabinoidów nie można analizować bez uprzedniej derywatyzacji w celu ochrony labilnej grupy karboksylowej. Ponieważ trudno jest przeprowadzić ilościową derywatyzację dla wszystkich składników w złożonej mieszaninie, analiza GC ma jedynie ograniczoną wartość przy badaniu autentycznego składu produktów z konopi indyjskich. Podczas analizy kannabinoidów w ich autentycznej postaci preferowaną metodą jest HPLC. Wykorzystując detektor z matrycą UV lub fotodiodami (PDA), kannabinoidy można skutecznie analizować bez powodowania degradacji składników próbki.
Leki oparte na produktach naturalnych są zwykle trudne do zbadania. Materiały roślinne mogą zawierać wiele (strukturalnie) blisko spokrewnionych związków i często nie jest jasne, co to jest składnik aktywny, jeśli w rzeczywistości istnieje tylko jeden. Czasami biologicznie aktywne składniki rośliny zostały scharakteryzowane tylko częściowo (np. Ginkgo biloba, ziele dziurawca, Hypericum perforatum, Echinacea purpurea). Ze względu na złożoność roślin leczniczych, niektóre ważne warunki wiarygodnego badania produktów naturalnych to: dostępność metod analitycznych, które umożliwiają badanie składników bez degradacji próbki; wzorce odniesienia interesujących związków; oraz jasny przegląd właściwości fizykochemicznych, spektroskopowych i chromatograficznych składników próbki. W przypadku badania kannabinoidów dostępne metody analityczne zostały ostatnio szeroko przeanalizowane przez Raharjo [2004]. Zdecydowanie najczęściej stosowanymi metodami chromatograficznymi były wysokosprawna chromatografia cieczowa (HPLC) i chromatografia gazowa (GC). Zastosowanie GC, zwykle sprzężonego z detekcją płomieniowo-jonizacyjną (FID) lub detekcją masową (MS), pozwala na analizę dużej różnorodności kannabinoidów o bardzo wysokiej rozdzielczości. Jednak główną wadą GC jest fakt, że kwaśnych kannabinoidów nie można analizować bez uprzedniej derywatyzacji w celu ochrony labilnej grupy karboksylowej. Ponieważ trudno jest przeprowadzić ilościową derywatyzację dla wszystkich składników w złożonej mieszaninie, analiza GC ma jedynie ograniczoną wartość przy badaniu autentycznego składu produktów z konopi indyjskich. Podczas analizy kannabinoidów w ich autentycznej postaci preferowaną metodą jest HPLC. Wykorzystując detektor z matrycą UV lub fotodiodami (PDA), kannabinoidy można skutecznie analizować bez powodowania degradacji składników próbki.
Jednak trudno jest oddzielić wszystkie główne kannabinoidy za jednym razem. Aby przezwyciężyć ten problem, coraz ważniejsze staje się stosowanie detekcji masy (LC-MS) do rozróżniania nakładających się pików chromatograficznych [Stolker, 2004; Hazekamp, 2005]. Niezależnie od metody zastosowanej do analizy kannabinoidów, potrzebne są wiarygodne standardy badanych związków, aby umożliwić wysokiej jakości ilościowe badania farmakologicznych i leczniczych aspektów konopi. Jednak w momencie rozpoczęcia pracy nad tą rozprawą, tylko kilka głównych kannabinoidów było dostępnych na rynku (THC, CBD, CBN i ∆8-THC). Nawet kannabinoid obecny w najwyższym stężeniu w jakiejkolwiek roślinie konopi typu narkotykowego, THCA, nie był jeszcze dostępny na rynku. Bez wątpienia ten brak standardów referencyjnych jest wielką przeszkodą w szczegółowym badaniu i zrozumieniu konopi. Chociaż dane spektroskopowe i chromatograficzne zostały opublikowane dla większości znanych kannabinoidów podczas eksperymentów izolacji i identyfikacji (przegląd patrz Turner i wsp. [1980]), są one rozproszone w ogromnej liczbie artykułów naukowych. Ponadto nie przedstawiono dotychczas znormalizowanych danych uzyskanych w identycznych warunkach analitycznych. Jest to godne ubolewania, ponieważ podczas studiowania złożonej fitomedycyny, takiej jak konopie, ważne jest, aby komunikować się na ten temat w ustandaryzowany sposób. Przecież różnice w metodach analitycznych lub w interpretacji wyników utrudniają dyskusję o nauce stojącej za konopiami. Takim różnicom można zapobiec, opracowując sprawdzone metody, które są zatwierdzane przez wszystkich zaangażowanych naukowców. W przypadku innych ważnych narkotyków (takich jak kokaina, opioidy, LSD) takie standardowe metody zostały opracowane i poddane krzyżowej walidacji między laboratoriami, co często skutkuje oficjalnymi tekstami Farmakopei. W przypadku konopi taki tekst nie był dostępny od kilkudziesięciu lat. Podsumowując, opublikowano wiele danych na temat konopi indyjskich i kannabinoidów, ale ich wartość jest ograniczona. Istnieje wyraźna potrzeba połączenia wszystkich elementów układanki konopi i uzyskania wiarygodnych, zweryfikowanych wyników.
Mechanizmy działania kannabinoidów
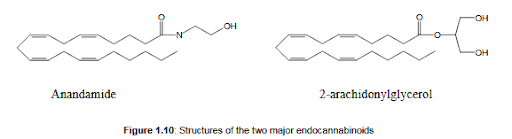
Do czasu odkrycia specyficznych receptorów konopi, biochemiczny sposób działania kannabinoidów był przedmiotem wielu dyskusji. Ze względu na swój lipofilny charakter kannabinoidy mogą przenikać przez błony komórkowe na drodze dyfuzji. Początkowo możliwe wyjaśnienia aktywności kannabinoidów obejmowały niespecyficzne wiązanie z błoną powodujące zmiany płynności i przepuszczalności błon nerwowych, hamowanie syntezy acetylocholiny, wzrost syntezy katecholamin oraz interakcję z wychwytem synaptosomalnym serotoniny [Dewey, 1986 ; Pertwee, 1988]. Jednak w połowie lat 80. ustalono, że aktywność kannabinoidów jest wysoce stereoselektywna [Mechoulam, 1992], co wskazuje na istnienie mechanizmu, w którym pośredniczy receptor. Pierwsze wiarygodne wskazówki, że kannabinoidy działają przez receptory, pojawiły się, gdy wykazano, że kannabinoidy mogą działać jako inhibitory drugiego przekaźnika szlaku cyklazy adenylanowej w tkance mózgowej i liniach komórkowych nerwiaka niedojrzałego. Ta aktywność była zależna od dawki, stereospecyficzna i mogła być modulowana przez pertussistoksynę [Howlett, 1985, 1986, 1987; Devane, 1988; Bidaut-Russell, 1990]. Wreszcie, znaleziono i sklonowano stereospecyficzny receptor kannabinoidowy sprzężony z białkiem G (CB-1) [Matsuda, 1990]. Receptor CB-1 jest najwyraźniej obecny w ośrodkowym układzie nerwowym, ale występuje również w niektórych narządach i tkankach obwodowych. Między innymi hamuje aktywność cyklazy adenylanowej i otwieranie kanałów wapniowych typu N [Mackie, 1992]. Wkrótce potem stwierdzono drugi, okołonośny receptor kannabinoidowy (CB-2), który może odgrywać rolę w procesach immunologicznych [Munro, 1993]. Jego działanie ujawnia się w narządach i komórkach odpornościowych, takich jak leukocyty, śledziona i migdałki, i wykazuje inną selektywność niż działający centralnie CB-1. Jak dotąd fizjologiczne role receptorów CB-2 okazały się trudne do ustalenia, ale przynajmniej jedna z nich wydaje się być modulacją uwalniania cytokin (Molina-Holgado, 2003). Zaskakujące jest, że istnieje zaledwie 45% homologii między receptorami CB-1 i CB-2. Opierając się na obserwacji, że wszystkie naturalne kannabinoidy są dobrze rozpuszczalne w tłuszczach, podjęto próbę wyizolowania endogennych ligandów dla receptorów kannabinoidowych z tkanek tłuszczowych zwierząt. Wreszcie, można było wyizolować pojedynczy związek z tkanki mózgowej świni, o wysokim powinowactwie do receptora CB1, nazwany anandamidem (etanoloamina kwasu arachidonowego) [Devane, 1992]. Później z jelita psa wyizolowano pokrewny związek wykazujący powinowactwo do receptorów kannabinoidowych; 2-arachidonylo-glicerol (2-AG, patrz rysunek 1.10)) [Mechoulam, 1995]. W ostatnich latach wyizolowano lub zsyntetyzowano dużą różnorodność związków o aktywności endokannabinoidowej [Mechoulam, 1998; Pertwee, 2006b], co ciekawe, wszystkie mają strukturę eikozanoidów. Receptory kannabinoidowe i ich endogenne ligandy razem tworzą tak zwany endogenny system kannabinoidowy (endokannabinoidowy).
Nie wszystkie skutki kannabinoidów można wytłumaczyć efektami zależnymi od receptorów i uważa się, że przynajmniej niektóre efekty są niespecyficzne i spowodowane przez ruchy błony [Makriyannis, 1995] lub przez wiązanie się z jeszcze nieznanymi celami w komórce . Stwierdzono w preparatach izolowanych naczyń krwionośnych, że niektóre endokannabinoidy mogą aktywować receptory waniloidowe na neuronach czuciowych [Zygmunt, 1999], co podnosi prawdopodobieństwo, że endokannabinoidy są endogennymi agonistami receptorów waniloidowych [Pertwee, 2005]. Dlatego te receptory można przypuszczalnie uważać za receptory CB-3. System sygnalizacji kannabinoidów ma pod względem teleologicznym miliony lat, ponieważ został znaleziony u ssaków, ryb i bezkręgowców, aż po bardzo prymitywne organizmy, takie jak hydra [De Petrocellis, 1999]. Rzeczywiście, istnieją przesłanki wskazujące na to, że receptory CB są ewolucyjnie spokrewnione z receptorami waniloidowymi [McPartland, 2002]. Potencjał terapeutyczny Preparaty z konopi indyjskich były stosowane w leczeniu wielu chorób, z wyraźnymi różnicami w dostępnych danych pomocniczych. Badania kliniczne z pojedynczymi kannabinoidami (naturalnymi lub syntetycznymi) lub preparatami z całych roślin (np. Wędzona marihuana, kapsułkowany ekstrakt) często inspirowane były pozytywnymi, anegdotycznymi doświadczeniami pacjentów stosujących surowe produkty z konopi indyjskich do samodzielnego leczenia. Odkryto przeciwwymiotne [Dansak, 1997], zwiększające apetyt [Plasse, 1991], przeciwbólowe [Noye, 1974] i zwiotczające mięśnie [Clifford, 1983] oraz terapeutyczne zastosowanie w zespole Tourette’a [Muller-Vahl, 1999]. ponownie odkryte w ten sposób. Przypadkowe obserwacje ujawniły również terapeutycznie użyteczne efekty. Odkrycie obniżonego ciśnienia wewnątrzgałkowego po podaniu THC, potencjalnie użytecznego w leczeniu jaskry, zostało dokonane nieoczekiwanie podczas systematycznych badań zdrowych użytkowników konopi indyjskich [Hepler, 1971]. Jednak anegdoty dotyczące skuteczności konopi lub THC we wskazaniach, które nie zostały potwierdzone w kontrolowanych badaniach, należy oceniać z ostrożnością. Chociaż większość znanych kannabinoidów została przetestowana w celu opisania ich względnej siły w porównaniu z THC (w testach wiązania receptora lub w testach specyficznych dla THC), do niedawna praktycznie nic nie było wiadomo o ich własnej aktywności biologicznej. Jednak testowanie kannabinoidów innych niż THC jako poważnych kandydatów do nowych potencjalnych klientów może czasami prowadzić do całkowicie sprzecznych z intuicją wyników, jak pokazano w przypadku THV. Jego siła jest około ¾ mocy THC w klasycznych testach in vitro, [Turner, 1980; Hollister, 1974], podczas gdy dopiero niedawno testy in vivo wykazały, że THV jest raczej antagonistą aktywności THC [Thomas, 2005]. I chociaż CBN był początkowo uważany za nieaktywny produkt degradacji THC, później odkryto, że ma kilka interesujących własnych aktywności [Herring, 2001; Styczeń 2002]. I chociaż w silnym materiale roślinnym THCA może być obecny na poziomie ponad 20% suchej masy, jego aktywność pozostawała niezbadana przez dziesięciolecia. Wartość terapeutyczną kwaśnego kannabinoidu THCA jako środka immunomodulującego odkryto dopiero niedawno [Verhoeckx, 2006], a jego działanie zostało opatentowane. Przykłady takie jak te pokazują, że badanie marihuany medycznej powinno obejmować, o ile to możliwe, całą gamę obecnych kannabinoidów [McPartland, 2001]. Potencjał terapeutyczny kannabinoidów można dodatkowo wyjaśnić, wskazując na centralne fizjologiczne znaczenie układu endokannabinoidowego oraz jego homologię i interakcję z układem endorfin. Oprócz roli modulatora przyjmowania pokarmu, system kannabinoidowy jest zaangażowany w kilka funkcji fizjologicznych i może być powiązany z ogólnym systemem regeneracji po stresie. Ta różnorodność efektów została zwięźle podsumowana przez Di Marzo i wsp. [1998], którzy stwierdzili, że kannabinoidy pomagają „odczuwać mniejszy ból, kontrolować ruch, relaksować się, jeść, zapominać (pourazowo), spać i chronić neurony”.
Aktywacja endogennego systemu kannabinoidowego może stanowić kluczowy i ważny składnik każdej z tych funkcji. Jedną z jeszcze niesprawdzonych, ale intrygujących koncepcji jest to, że endokannabinoidy mogą nadawać organizmowi „ton przeciwbólowy”, a poziom ich produkcji działa jak rodzaj termostatu przeciwbólowego. Jest prawdopodobne, że taki system opiera się na połączonych działaniach szeregu związków. Strategie modulowania aktywności endokannabinoidów obejmują hamowanie wychwytu zwrotnego do komórek i hamowanie ich degradacji w celu zwiększenia koncentracji i czasu działania. Wpływ kannabinoidów roślinnych na interakcję z takim układem endokannabinoidowym może być na wielu poziomach, z wyjątkiem samego wiązania receptora. Niektóre z takich interakcji zostały już opisane [Watts, 2004]. Układ endokannabinoidowy, który jest odpowiedzialny za naszą fizjologiczną odpowiedź na używanie konopi indyjskich, jest pod wieloma względami analogiczny do układu endorfin. Powszechnie wiadomo, że opioidy i kannabinoidy mają kilka wspólnych efektów farmakologicznych, w tym antynocycepcję, hipotermię, hamowanie czynności lokomotorycznej, niedociśnienie i uspokojenie [Cichewicz, 2004]. Ponadto pokazano przesłuchy między dwoma systemami [Corchero, 2004]. Zarówno kannabinoidy, jak i opioidy wytwarzają znieczulenie poprzez mechanizm sprzężony z białkiem G, a działanie przeciwbólowe THC jest, przynajmniej częściowo, pośredniczone przez receptory opioidowe, co wskazuje na bliski związek między kannabinoidami i opioidami szlakami sygnałowymi w modulacji odczuwania bólu [ Cichewicz, 2004]. Chociaż zarówno kannabinoidom, jak i opioidom towarzyszą niepożądane skutki uboczne przy dużych dawkach, stwierdzono, że THC może zwiększać siłę opioidów, takich jak morfina, tym samym radykalnie zmniejszając dawkę potrzebną do kontroli bólu [Williams, 2006]. W przeszłości nadużywanie opium doprowadziło do badania fizjologicznych skutków składników opium, co z kolei doprowadziło do odkrycia receptorów opioidowych. W rezultacie powstał jeden z naszych najważniejszych obecnie stosowanych leków: morfina. Historia konopi była dokładnie analogiczna do historii opium, aż do momentu odkrycia układu endokannabinoidowego. Jednak wydaje się, że istnieje niechęć do zrobienia ostatniego kroku i przekształcenia kannabinoidów w prawdziwe lekarstwo. Przegląd przeprowadzony przez Amerykański Instytut Medyczny skomentował, jak niewiele wiemy o kannabinoidach w porównaniu z opiatami [Joy, 1999]. Jednak mózg ma więcej receptorów CB1 niż opioidów. Analogia między historią badań obu grup sugeruje dobry powód do optymizmu co do przyszłości rozwoju leków kannabinoidowych [Vigano, 2005; Pertwee, 2006]. 1.4.3 Leki z konopi indyjskich Główną przeszkodą w rozwoju leków na bazie kannabinoidów jest niska rozpuszczalność kannabinoidów w wodzie [Garrett, 1974], co utrudnia opracowanie skutecznych preparatów do użytku przez ludzi [Hazekamp, 2006]. Niemniej jednak coraz więcej firm farmaceutycznych zaczyna podchodzić do idei kannabinoidów lub ich antagonistów jako leków terapeutycznych. Obecnie dostępnych jest wiele leków opartych na biologicznej aktywności kannabinoidów, takich jak Marinol, Nabilone i Sativex. Marinol (dronabinol, syntetyczny ∆9-THC) i Cesamet (nabilon, pochodna THC) są zarejestrowane we wskazaniu nudności i wymiotów związanych z chemioterapią przeciwnowotworową. Marinol jest również zatwierdzony do leczenia anoreksji i kacheksji w HIV / AIDS. Chociaż istnieją wyraźne wskazania, że niektóre efekty mogą się różnić w zależności od faktu, że kannabinoid jest przyjmowany sam lub w połączeniu z innymi kannabinoidami, praktycznie nie wykonano żadnej pracy nad działaniem połączonych kannabinoidów. Jednym ważnym wyjątkiem są badania kliniczne kombinacji THC i CBD w produkcie leczniczym Sativex [Russo, 2006], który jest obecnie zarejestrowany tylko w Kanadzie. Oczekuje się, że w najbliższej przyszłości zostanie wprowadzonych kilka nowych produktów na bazie kannabinoidów. Należą do nich Rimonabant (Acomplia, Sanofi-Aventis) [van Gaal, 2005] i silny przeciwbólowy kwas ajulemowy [Burstein, 2004]. Rymonabant został opracowany na podstawie obserwacji, że spożywanie konopi indyjskich często prowadzi do nienasyconego uczucia głodu, znanego również jako „przekąski”. Rymonabant jest antagonistą receptora CB1 i powoduje zjawisko odwrotne. Ma zostać wprowadzony na rynek w najbliższej przyszłości i ma stać się głównym lekiem w walce z otyłością. Kwas ajulemowy (AJA) jest syntetycznym analogiem ludzkiego metabolitu THC, kwasu THC-11-owego . Chociaż mechanizm działania AJA pozostaje w dużej mierze nieznany, ma silne działanie przeciwbólowe i przeciwzapalne, bez psychotropowego działania THC. W przeciwieństwie do niesteroidowych leków przeciwzapalnych, AJA nie wywołuje wrzodów w dawkach terapeutycznych, co czyni go obiecującym lekiem przeciwzapalnym. Chociaż wydaje się jasne, że konopie indyjskie nadal mają bardzo istotny potencjał w medycynie, jasne jest również, że medyczne użycie konopi nie jest panaceum. Konopie indyjskie, jak każdy inny lek, mogą powodować skutki uboczne, zwłaszcza gdy są spożywane w dużych ilościach. Jednak szeroko wyrażona opinia na temat niepożądanych działań konopi indyjskich i THC została sformułowana w raporcie amerykańskiego Instytutu Medycznego z 1999 r. Na temat medycznego stosowania konopi indyjskich: „Marihuana nie jest substancją całkowicie łagodną. Jest to silny lek o różnym działaniu. Jednak z wyjątkiem szkód związanych z paleniem, niekorzystne skutki używania marihuany mieszczą się w zakresie działań tolerowanych przez inne leki ”[Joy, 1999]. Toksyczne właściwości marihuany zależą głównie od zawartości kannabinoidów. Uważa się, że toksyczność narkotyków z konopi indyjskich i kannabinoidów jest ogólnie niska i porównywalna z akceptowanymi społecznie produktami psychoaktywnymi, takimi jak kawa, alkohol i tytoń [Hollister, 1986]. Więc nawet jeśli rola kannabinoidów we współczesnej terapii pozostaje niepewna, istnieje wystarczająco dużo wskazówek, aby zdać sobie sprawę, że nieracjonalne byłoby dalsze jej badanie. Ogólnie rzecz biorąc, istnieje 5 głównych obaw związanych z używaniem konopi indyjskich: 1) niesłabnący wzrost używania, 2) stały spadek wieku pierwszego użycia, 3) zwiększone ryzyko psychozy u osób wrażliwych, 4) stały wzrost używania konopi indyjskich intensywni użytkownicy szukający pomocy w rzuceniu konopi indyjskich oraz 5) zwiększone ryzyko wypadków drogowych. Jednak te obawy nie powinny powstrzymywać badań naukowych nad używaniem konopi w medycynie. Zamiast tego należy dokonać wyraźnego rozróżnienia między zastosowaniem terapeutycznym a rekreacyjnym.
